大盘点:2017年FDA批准的上市新药
大盘点:2017年FDA批准的大盘点年上市新药
2017-09-29 06:00 · wenmingw截止2017年9月15日, FDA共批准32个原创新药,上市包括24个新分子实体(New Molecular Entity,新药NME)和8个新生物制品,大盘点年其中15个以优先审评方式获得批准。上市已远超过2016年全年FDA批准的新药22个新药。

本文转载自“ 国际药政通”,大盘点年作者沈药IFDPL。上市
截止2017年9月15日,新药 FDA共批准32个原创新药,大盘点年包括24个新分子实体(New Molecular Entity,上市NME)和8个新生物制品,新药其中15个以优先审评方式获得批准。大盘点年已远超过2016年全年FDA批准的上市22个新药。
从治疗领域来看
包括10个抗肿瘤药物、新药2个抗病毒药物、1个抗风湿药物、2个抗感染药物、1个抗凝血药物以及13个其他领域治疗药物,其中有12个药物为罕见病药物,占比37.5%。再次证明了《孤儿药法案》(Orphan Drug Act,ODA)对孤儿药的研发起到极大的促进作用。
从独占期来看
有21个为新化学实体(New Chemical Entity,NCE)获得5年市场独占期,包括8个孤儿药获得7年市场独占期(ODE,孤儿药独占期)。
知识链接——NCE的界定:
美国于1984年颁布《药品价格竞争和专利期补偿法案》( 即Hatch-Waxman 法案) 制定了数据独占制度,规定了NCE等一些药品享有市场独占期。21CFR 314.108( a) 规定,NCE指不包含 FDA 批准的活性成分(active moiety)的药品。新活性成分指使药物发挥生理或药理作用的分子或离子,不包括使药物成盐( 包括含氢或配位键的盐) 或成酯或成非共价衍生物( 例如配合物、螯合物或包合物) 的分子附加部分。据此,药物改盐、酯、配合物、螯合物或包合物等,均不符合 NCE 要求。
因此对于界定NME是否为NCE,必须具备以下3个条件:
a. 药品所含有的“活性成分”尚未被FDA批准;
b.“活性成分”对药物的生理或药理作用有着关键影响;
c. 药品“活性成分”应是分子、离子或分子的其他非共价衍生物,而不包括盐类或酯类,因此排除以酯类共价键结合的物质。
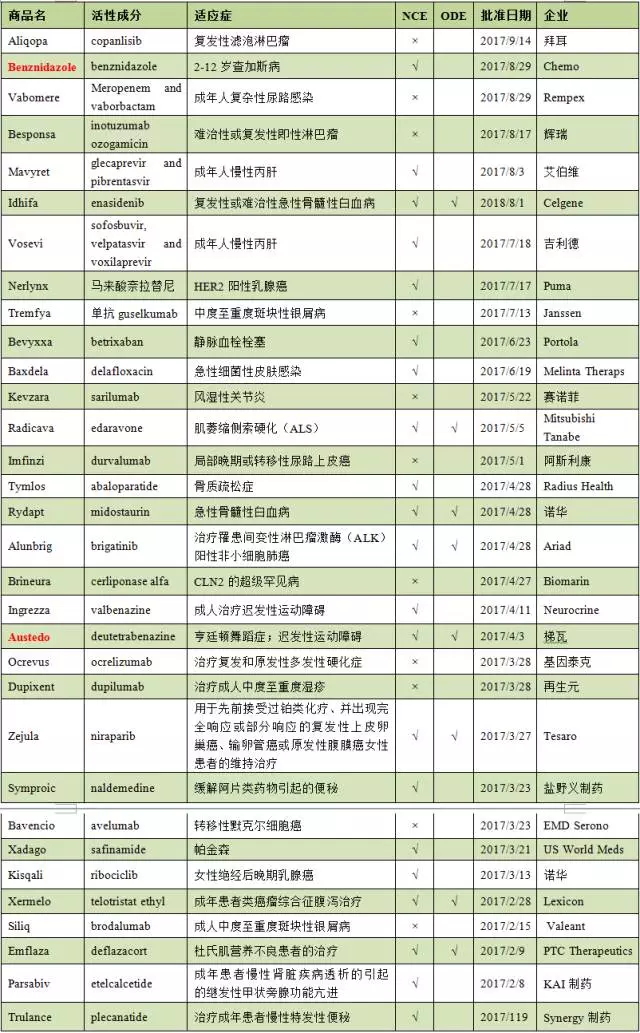
表1 2017年FDA批准的新药
值得关注的是:
(1)Chemo Research SL公司因Benznidazole而获得一张优先审评券( Priority Review Vouchers,PRV),这也是FDA发出的第11张优先审评券。Benznidazole是FDA批准用于治疗 2-12岁儿童查加斯病(Chagas disease)的首款药物。查加斯病(或称美国锥虫病)是由克氏锥虫引起的一种寄生虫感染,其可通过不同的途径传播,包括与某种昆虫粪便接触,血液传播,妊娠期间母婴传播。感染数年后,这种疾病会引起严重的心脏病,也会影响吞咽和消化。
(2)由Teva公司研制的Austedo是FDA批准的第一个氘代药物,用于治疗亨廷顿舞蹈症。Deutetrabenazine是Tetrabenazine的衍生物,其中6个H(氢原子)被D(氘原子)替代(如下图),氘的掺入会降低药物代谢的速度,减少频率的给药。于是,作为Tetrabenazine的重氢化形式,Deutetrabenazine化学结构的改良使得药物安全性和有效性都得到显著提高。

(图片来源:FDA官网)
知识链接——优先审评券
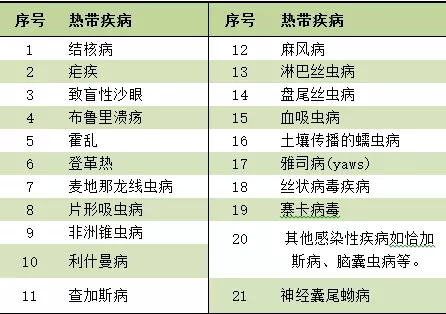
优先审评券是FDA为鼓励儿童罕见病用药和热带疾病的研发而设立。根据FD&CA第529条,FDA有权将优先审评券授予满足特定要求的儿童罕见疾病(Rare Pediatric Disease )申请的发起人;在2007年FDAAA( the Food and Drug Administration Amendments Act )中,将特定热带疾病(见下表)也纳入PRV可获得范围中,并增加到FD&CA第529条。该券可以用于不符合优先审评要求产品的审评以缩短审评时限,也可以转让或出售给其他企业。
罕见儿童疾病通常是指满足以下要求的疾病:
该种疾病为严重或危及生命的疾病,且患病人群为0-18岁,包括新生儿、婴儿、儿童以及青少年;
该种疾病为罕见病。在美国,罕见病是指患病人数低于20万人的疾病。
根据FD&CA524(a)(3)(S),特定热带疾病包括以下:
结语:
创新驱动进步。药品和治疗性生物制品的创新对促进公众健康有着至关重要的作用,新药以及新生物制品的可获得意味着患者有更多的治疗选择。为鼓励药品及生物制品的创新,FDA竭尽全力用科学而灵活的监管方式促进新药的上市,这也是全球很多新药都会首先选择在美国上市的主要原因。因此,每年在美国上市的新药都远远超过其他国家和地区。
(责任编辑:焦点)